La réaction chimique chlore – eau, l’influence du pH et du rayonnement solaire

Le chlore est un désinfectant puissant. Quelque soit sa forme (galet, pastilles, sels, liquide, gaz), son pouvoir désinfectant se libère au contact de l’eau, sous la forme d’acide hypochloreux (HClO).
C’est lui qui est responsable du travail d’oxydation des micro-organismes et de désinfection de l’eau. Il s’attaque à la matière organique inerte sous toutes ses formes : végétation, bactéries, parasites, virus, algues.
Son pouvoir désinfectant est lié à la réaction chimique produite au contact de l’eau. Il est aussi influencé par le pH et le rayonnement solaire.
Au contact de l’eau, les produits chlorés génèrent de l’acide hypochloreux (HClO), aussi appelé Chlore Libre
Lorsque le Chlore pur entre en contact avec l’eau, il réagit de la manière suivante.
Cl2 + H2O –> HClO + HCl
Chlore + Eau –> Acide hypochloreux + Acide Chlorhydrique
Les réactions chimiques qui se produisent avec les autres désinfectants à base de Chlore sont les suivantes.
Eau de Javel (chlore non stabilisé)
NaOCl + H2O –> HClO + NaOH
Hypochlorite de Sodium + Eau –> Acide hypochloreux + Soude
Hypochlorite de Calcium ou HTH (chlore non stabilisé)
Ca(OCl)2 + 2 H2O –> 2 HClO + Ca(OH)2
Hypochlorite de Calcium + Eau –> Acide hypochloreux + Chaux
Dichlore, Trichlore (chlore stabilisé)
DCCNa + 2 H2O –> 2 HClO + CCNa
DiChloroIsoCyanurate de Sodium + Eau –> Acide hypochloreux + Acide IsoCyanurique
ATCC + 3 H2O –> 3 HClO + ACC
Acide TriChloroIsoCyanurique de Sodium + Eau –> Acide hypochloreux + Cyanurate de Sodium
Lire ou relire l’article sur les différentes formes de Chlore de piscine pour plus de détails sur les composés chlorés utilisés en piscine (Hypochlorite de Sodium, Hypochlorite de Calcium, DiChloroIsoCyanurate de Sodium, Acide TriChloroIsoCyanurique).
Quelque soit la source de chlore utilisée, la réaction génère de l’acide hypochloreux, également appelé Chlore libre, dont une partie seulement (le chlore actif) est active pour la désinfection.
La réaction chimique génère par ailleurs des dérivés chlorés secondaires appelés chloramines ou chlore combiné.
Ces dérivés naissent de l’interaction entre :
– chlore libre et particules introduites dans l’eau par les baigneurs (sueur, crèmes solaires, résidus textiles) et l’environnement (feuilles, insectes, déchets divers)
– chlore libre et micro-organismes en cours de prolifération dans l’eau (bactéries, virus, algues, parasites…).
On peut résumer cette équation par Chlore total = Chlore libre + Chlore combiné.
Le pouvoir désinfectant du chlore baisse lorsque le pH monte
Le pH (potentiel Hydrogène) et le Chlore libre interagissent.
La dose de Chlore libre qui est générée par la réaction chimique est liée au pH. Lire ou relire l’article sur le rôle clé du pH dans le traitement de l’eau pour plus de détails.
L’eau (H2O) est composée de 2 atomes d’hydrogène et 1 atome d’oxygène.
Les atomes d’hydrogène contiennent des ions Hydrogènes positifs (H+) et négatifs (H-). Un pH à 7 indique une eau neutre, équilibrée en ions positifs / négatifs. C’est celui d’une eau naturelle et pure.
Comme tous les acides au contact de l’eau, l’acide hypochloreux est régit par un équilibre de dissociation :
HClO ClO- + H+
Acide Hypochloreux ion hypochlorite négatif + ion hydrogène positif
L’eau et l’acide hypochloreux sont donc tous les 2 composés d’ions hydrogènes.
Leur interaction va donc déséquilibrer le potentiel Hydrogène de l’eau : le fameux pH.
A mesure que l’on ajoute du Chlore, le pH augmente. Et dans le même temps, la présence plus ou moins importante d’ions hydrogènes va rendre le rapport acide hypochloreux/ion hypochlorite plus ou moins actif contre les micro-organismes.
En clair :
– Plus on ajoute de Chlore, plus le pH augmente.
– Plus le pH augmente, moins le Chlore libéré (Acide Hypochloreux) est actif contre les micro-organismes.

Cela montre bien l’importance que l’on doit attacher au pH.
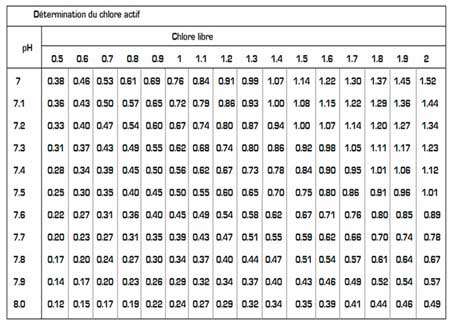
Les abaques ci-dessous permettent d’avoir une idée de la concentration du chlore actif dans le chlore libre quand le pH monte.
La puissance bactéricide de l’HClO sera sensiblement la même avec :
– 0,5 mg/l de chlore à pH 7
– 0,7 mg/l de chlore à pH 7,4
– 1 mg/l de chlore à pH 7,7
– 1,4 mg/l de chlore à pH 7,9
– 2 mg/l de chlore à pH 8,2
On peut résumer cette équation par
Chlore total = Chlore libre + Chlore combiné
Chlore libre = HClO + ClO-
Chlore actif = f(Chlore libre, pH)
Il ne faut pas tomber dans la fausse bonne solution d’augmenter inutilement les doses de chlore. Bien au contraire, l’augmentation du dosage est néfaste car le chlore combiné généré est irritant pour l’organisme humain (pique les yeux, muqueuses), les textiles (maillots de bain) et les équipements du bassin (revêtement), sans pour autant augmenter fortement l’action du chlore actif contre les micro-organismes.
Il faut stabiliser l’action du chlore parce que les rayonnements ultra-violets le détruisent
Dans une piscine en plein air, il est par ailleurs difficile de maintenir le taux de chlore à cause du rayonnement solaire et la température de l’eau.
Les ultraviolets provoquent une destruction photochimique de l’oxygène contenu dans l’ion hypochlorite (ClO-) de l’acide hypochloreux (HClO). Il est libéré dans l’air, entraînant une perte importante de chlore actif.
Depuis longtemps, les chimistes cherchent un moyen de diminuer cette destruction tout en conservant des propriétés bactéricides correctes. Le seul produit répondant à ces contraintes est l’acide isocyanurique, appelé stabilisant, qui agit comme un filtre à ultra-violets. En se combinant avec le chlore, il forme des composés chlorés actifs stabilisés qui sont moins sensible au rayonnement solaire.
Cette stabilisation est effective à partir d’une teneur en stabilisant de 25 ppm (partie par million) ou 25 mg/l (milligramme par litre).
Un des moyens pour procéder est d’ajouter un produit dit stabilisant (si l’on utilise du chlore non stabilisé) ou d’utiliser du chlore stabilisé, pour prolonger l’action du chlore. Ceci explique pourquoi les traitements aux chlorocyanuriques (Dichlore, Trichlore), également appelé chlore stabilisé sont largement plébiscités, car ils permettent d’administrer le chlore et de le stabiliser en même temps.
Cela dit, il ne faut pas mettre trop de stabilisant car au delà d’un certain taux, il empêche la formation d’acide hypochloreux ou chlore libre, rendant le chlore inoffensif contre les micro-organismes.
Dans les piscines publiques en France, la législation impose un taux de stabilisant inférieur à 75 ppm ou 75 mg/l. Il n’y a pas d’obligation légale en ce qui concerne les piscines privées.
La piscine est un domaine technique où on ne peut faire l’impasse de quelques connaissances sur les produits de traitement et la chimie de l’eau. Si vous rencontrez un problème avec votre eau de piscine (mal équilibrée, mal désinfectée, couleur bizarre que vous n’arrivez pas à rattraper), la meilleure solution est de faire appel à un professionnel.
| Aperçu | Nom | Prix |
|---|---|---|
|
1
|
HTH Spa - Recharge Pooltester Chlore / pH - pastilles
|
14,85 €
11,71 €
|
|
2
|
HTH Spa - Pooltesteur Chlore / pH - pastilles
|
23,40 €
19,20 €
|
|
3
|
BAYROL Spa Time - Chlore Multifonction - 1kg
|
24,90 €
19,90 €
|
|
4
|
BAYROL Spa Time - Chlore Granulés - 1kg
|
24,00 €
21,50 €
|
|
5
|
Douche solaire piscine PVC 20 L
|
179,00 €
170,05 €
|
|
6
|
Douche solaire piscine PVC 35 L + rinçe pied
|
249,00 €
236,55 €
|







Commentaires
Le 13 août 2022 à 15 h 59 min, lionel a dit :
je me demandais s'il n'y avais pas une inversion:
"DiChloroIsoCyanurate de Sodium + Eau –> Acide hypochloreux + Acide IsoCyanurique" ce ne serait pas plutot du cyanurate de sodium ?
et l'acide Cyanurique ne serait pas généré pas l'ATCC ?
Est ce quel le cyanurate est aussi stabilisant que l'acide cyanurique ?
en tout cas merci pour votre article très bien expliqué !
Le 5 décembre 2022 à 15 h 07 min, @PiscineInfoService.com a dit :
Non, il n’y a pas d’inversion. Le DiChloroIsoCyanurate de Sodium se dissout en Acide hypochloreux et Acide IsoCyanurique lorsqu'il est mélangé à de l'eau. L'acide Cyanurique ne sera pas généré par l'ATCC mais le cyanurate de sodium peut servir comme stabilisant pour les produits chimiques contenant des ions oxygène libres (tels que les acides chlorhydriques et hypochlorites), sachant qu'il n'est pas aussi stable que l'acide cyanurique et peut se décomposer facilement.
Le 28 avril 2019 à 17 h 02 min, philippe goulet a dit :
Bonjour, pour améliorer votre article, serai-il possible de faire une correlation ajout d'acide par gramme/litre de chlore ajouter à l'eau? Il semble qu'il serait bien de pouvoir ajouter un acidifiant en quantité, calculé par rapport au chlore que l'on veut ajouter. J'ai lu quelque part que, par exemple, 4 onces liquide d'acide muriatique devrait êtres ajouté pour compenser la hause du pH induite par 1lb d'hypochlorure de Calcium.
Le 28 mars 2017 à 16 h 58 min, Jordan a dit :
Acide hypochloreux = ClOH et non HOCl, merci !
Le 3 avril 2017 à 9 h 44 min, Anthony a dit :
Merci de votre remarque. Vous avez raison (formule erronée). Il semble même que ce soit HClO.... L'article vient d'être rectifié
Le 19 janvier 2017 à 9 h 47 min, Eddy Malou a dit :
Bonjour, je ne sais pas si je poste ça au bon endroit, mai voilà je voudrais exposer mon problème honnêtement. Je suis atteint par le SIDA depuis 10 ans et je ne le vis pas très bien... Je me demandais si le pH élevé de ma piscine peut influer sur mon état ? J'ai vraiment peur.
Le 21 janvier 2017 à 6 h 13 min, Anthony a dit :
Bonjour Eddy
A priori il n'y a pas de rapport.
Le corps humain est composé à 70% d'eau et de liquides divers. Or chaque liquide du corps a son propre pH (sang, séminal, urée, bile, etc).
Cela étant, je comprends votre stress et vos questionnements. Et je ne me suis pas qualifié pour être catégorique sur l'impact ou non, les risques ou non, et les précautions éventuelles à prendre pour une personne porteuse du VIH.
Il me semble que c'est à votre ou vos médecins qu'il faut en parler en priorité.
Et dans une moindre mesure, sur un forum ou un groupe de discussion de personnes concernées par le SIDA.
Bon courage
Le 23 janvier 2017 à 10 h 59 min, Eddy Malou a dit :
Merci beaucoup, ça me rassure ! Que Dieu veille sur vous !
Laisser un commentaire